ABSTRACT : En este artículo se aporta una explicación razonada a dos cuestiones sobre la anatomía del sistema nervioso central humano: ¿por qué la médula no ocupa por completo el interior del canal vertebral lumbar? y ¿cuál es el motivo por el cual el cono medular (CM) de los adultos (el extremo caudal de la médula espinal) se sitúa por encima de L3?
Para contestar a la primera cuestión recurriremos a la filogenia y ontogenia humanas. En los vertebrados, cuanto mayor es la amplitud de los movimientos de flexión antero-posterior y rotación del raquis, mayor es la diferencia entre la longitud de la médula y de la columna vertebral, lo que explica que en el hombre la médula no ocupe por completo el interior del canal vertebral lumbar.
Gracias a estudios de biomecánica podemos resolver la segunda cuestión. Durante la marcha, con cada paso la cintura escapular y la columna vertebral situada por encima de L3 giran al unísono en el mismo sentido. Por el contrario, la cintura pélvica y la zona de la columna situada por debajo de L3 giran en sentido contrario (contrarrotación). Si el CM se encontrara a un nivel inferior a L3, los movimientos de rotación y contrarrotación darían lugar a torsiones e isquemia medular. Como en el hombre el CM se encuentra por encima de L3, la médula en toda su extensión gira en el mismo sentido que la cintura escapular, evitándose así la aparición de torsiones medulares.
¿Cuál es el interés clínico de la biomecánica medular humana? Su estudio puede contribuir al conocimiento de la fisiopatología de enfermedades medulares tales como el Tethered cord syndrome y las siringomielias isquémicas, y ayudar al diseño de tratamientos médicos menos yatrogénicos en las enfermedades neurológicas de espalda.
INTRODUCCIÓN
En la anatomía de los seres vivos la forma tiene un sentido, una finalidad. Mantener diseños inútiles supondría un gasto energético extra que podría comprometer la supervivencia de una especie.
Entonces, si el diseño de los componentes anatómicos cumple una función fisiológica, ¿por qué la médula espinal humana no ocupa por completo el interior del canal vertebral? y ¿por qué el extremo caudal de la médula espinal, o cono medular (CM), se encuentra situado entre las vértebras T12 y L3? (1)
Según la ley biogenética de Haeckel, la ontogenia recapitula la filogenia (2). Los cambios morfológicos que se producen durante el desarrollo embrionario y crecimiento del individuo (ontogenia) reproducen, de forma abreviada, la historia evolutiva de su especie (filogenia). Aunque formulada en los siglos XVIII y XIX, los fundamentos de esta teoría todavía conservan hoy gran parte de su validez. Por este motivo, el estudio de la filogenia y la ontogenia humanas nos puede ayudar a comprender las relaciones entre la estructura y la función de la columna vertebral y la médula espinal.
FILOGENIA DE LA COLUMNA VERTEBRAL Y DE LA MÉDULA ESPINAL
En el transcurso de la evolución de las especies, la aparición de nuevas estructuras y funciones biológicas no supuso la desaparición de las antiguas sino que éstas, no siempre evidentes, persistieron bajo las modernas. Como veremos a continuación, en la anatomía de la columna vertebral y de la médula humanas podemos descubrir las soluciones adoptadas a lo largo de la evolución con la finalidad de proteger la médula espinal de los movimientos de la marcha.
Primeros cordados: Los cordados (filum Chordata) surgieron en el Cámbrico (525 Ma). Su anatomía se asemejaba a la de los actuales Amphioxus (Branchiostoma lanceolatum). No poseían cráneo, vértebras ni cerebro diferenciado sino una primitiva médula espinal situada bajo la notocorda, una estructura anatómica elástica cuya función era devolver el raquis a su forma original tras sus movimientos de lateroflexión. En el Amphioxus la notocorda y la médula espinal tienen aproximadamente la misma longitud.
Peces: A finales del Cámbrico, aquellos primeros cordados dieron lugar a los primeros vertebrados, los peces. La columna vertebral de los peces sustituyó a la notocorda como eje primario del cuerpo. En los peces, como en el resto de los vertebrados, persisten restos de la notocorda en los núcleos pulposos de los discos intervertebrales. Al igual que los Amphioxus, los peces se desplazan por el agua mediante movimientos de lateroflexión del raquis (fig.1A). Sus músculos natatorios se insertan en un esqueleto axial constituido por vértebras que poseen en la zona superior un arco neural. El conjunto de los arcos neurales forma el canal vertebral que alberga en su interior la médula espinal. En los peces, la columna vertebral y la médula espinal son de la misma longitud.
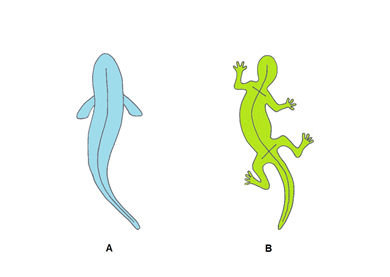 |
| Fig 1 A. Lateroflexión del raquis de los peces durante la natación. Fig 1 B. Lateroflexión del raquis de las salamandras durante la marcha. Las extremidades participan como puntos de apoyo. |
Anfibios y reptiles: Posteriormente, en el Devónico (395 Ma), un grupo de peces bentónicos que se desplazaban por el fondo de los ríos y lagos apoyados sobre sus aletas anteriores pudieron salir a tierra gracias a rudimentarios pulmones. Estos peces pulmonados evolucionaron dando lugar a anfibios y reptiles. Las cuatro patas de los anfibios caudados (salamandras y tritones) y de los reptiles cuadrúpedos participan en la marcha aunque, como en los peces, el principal propulsor sigue siendo el movimiento de lateroflexión del raquis (fig.1B).
En la mayoría de los peces, anfibios caudadados, reptiles y aves la médula ocupa casi por completo el interior del canal vertebral.
Mamíferos: La siguiente etapa en la evolución de los vertebrados fue la aparición, en el Cretácico (145 Ma), de los mamíferos cuadrúpedos. Tras la extinción masiva de los dinosaurios en el Paleoceno (66 Ma), los mamíferos se expandieron ocupando los nichos ecológicos abandonados por los dinosaurios.
Los mamíferos cuadrúpedos se desplazan mediante movimientos de lateroflexión del raquis, al igual que los anfibios y reptiles cuadrúpedos, asociados a movimientos de flexión ventral (o anterior) y dorsal (o posterior). Así, la columna vertebral se mueve abriéndose y cerrándose como un compás cuya bisagra estuviera situada en la zona entre tórax y abdomen. Para ello fue necesario que surgieran las curvaturas vertebrales y que los músculos espinales migraran desde la zona posterior a la anterior del raquis.
La médula espinal de los mamíferos es más corta que la columna vertebral. Así, por ejemplo, en el cerdo (Sus scrofa domestica) el CM se sitúa a nivel de L3-L5;(3) en las cobayas (Cavia porcellus) en L2-L5;(3) en el perro (Canis familiaris) en L3-L7;(3) en el lobo guará o de crin (Chrysocyon brachyurus) en L3-L6;(4) en el caballo (Equus ferus caballus) en L5-S2;(5) en el gato (Felis catus) en L6-S2;(6) en el conejo (Oryctolagus cuniculus) en L6-L7;(5) en la paca (Agouti Oryctolagus) en L5-L7;(7) en el búfalo (Bubalus bubalis) en S3;(8) en la oveja (Ovis aries) en S2;(8) en el lobo marino (Arctocephalus australis) en T6-T7;(9) en el equidna (Tachyglossus aculeatus) en T7 (10) y en el ornitorrinco (Ornithorhynchus anatinus) a nivel sacro. (10)
Llama la atención que en el equidna y en el lobo marino el CM se sitúe a nivel torácico. El equidna es un mamífero primitivo que, junto con el ornitorrinco, pertenece al orden taxonómico de los monotremas (mamíferos que ponen huevos). Estas dos especies de monotremas tienen el CM situado en distintos niveles de la columna: el equidna en la columna torácica y el ornitorrinco en la columna lumbar. ¿Por qué motivo su CM está situado a diferente nivel? Según Kappers (11) el CM del equidna se sitúa a nivel torácico porque posee una cola más corta y atrófica que la del ornitorrinco. Según Mitchelle (12) esta hipótesis no es correcta pues el CM de otros mamíferos sin cola, como el hombre, se encuentra en la zona lumbar. Recientemente Ashwell (10) ha atribuido la corta longitud de la médula espinal del equidna a que éste, cuando se siente en peligro, se enrolla sobre sí mismo como una pelota. Según este autor, si la médula del equidna ocupara el canal vertebral lumbar esta flexión vertebral forzada podría dañarla.
Una situación similar la encontramos en el lobo marino. Su CM está situado a nivel torácico, 8 vértebras más arriba que en el perro y el lobo terrestre, dos animales pertenecientes a su mismo suborden taxonómico, los carnívoros caniformes.
Como más adelante propondremos, esta localización del CM se explicaría por los grandes movimientos corporales de giro que realiza el lobo marino. Si el CM del lobo marino se encontrara a nivel lumbar, la torsión de la médula espinal provocaría su lesión.
Primates: Los primeros primates surgieron en el Paleoceno (66 Ma), poco después de la extinción de los dinosaurios. Eran pequeños mamíferos cuadrúpedos que se desplazaban por las ramas de los árboles con el cuerpo en posición horizontal (fig. 2 arriba). Poseían una columna lumbar larga, clavícula corta, omóplatos dispuestos lateralmente sobre el tórax y ojos lateralizados. Un grupo de estos primates evolucionó adaptando su cuerpo para trepar a los árboles en posición vertical. Para ello, su cabeza se flexionó hacia adelante y los ojos migraron frontalmente. La verticalización facilitó la braquiación, una modalidad de locomoción arbórea en la que los primates se desplazan por las ramas asidos con las manos y con los brazos extendidos (fig. 2 abajo a la izquierda).
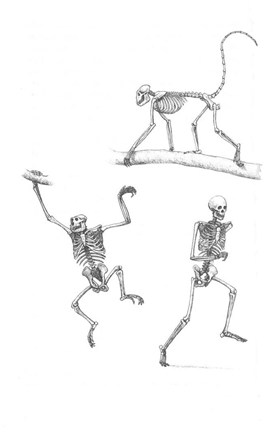 |
| Fig. 2. Esqueletos de primates. Arriba: cuadrúpedo. Abajo a la izquierda: braquiador. Abajo a la derecha: bípedo (hombre). Reproducidos con la autorización del autor de los dibujos Mauricio Antón.(13) |
Los primates braquiadores tienen dedos largos para asirse a las ramas, cintura escapular desarrollada, tórax aplanado en sentido dorsoventral, omóplatos en la parte posterior de la espalda y largas clavículas. Presentan una gran rigidez lumbo-sacra debido a que su columna lumbar es más corta que la de sus antecesores y el sacro está verticalizado. (14) A consecuencia de esta rigidez, durante la braquiación las vértebras lumbares giran en bloque en el mismo sentido que las vértebras dorsales, con lo cual ambas cinturas, pélvica y escapular, giran también en el mismo sentido.
Los primates actuales poseen entre 4 y 7 vértebras lumbares. El nivel en el que se sitúa el CM también es muy variado. En el chimpancé común (Pan troglodytes) el CM se encuentra en L2;(15) en el macaco (Macacus rhesus) en L4;(15) en el babuino (Papio papio) y en el galago (Galago senegalensis) en L6;(15) en el tití (Callithrix jacus jacus) en L2-L44 y en el mono ardilla (Saimiri sciureus) en S3 – Cc1.(4)
Homínidos: Hace 11,62 Ma en Europa existía un grupo de primates braquiadores bípedos que caminaban erguidos sobre las ramas de los árboles con las piernas extendidas. Tenían muy desarrollado el primer dedo de los pies, lo que les permitía soportar el peso corporal. La columna vertebral lumbar era relativamente larga, con una curvatura lordótica similar a la de los homínidos más evolucionados.(16)
De 5 a 10 Ma atrás, un grupo de primates braquiadores no bípedos descendieron de los árboles, alternando la vida arborícola y la terrestre. En sus desplazamientos por el suelo, la verticalización del raquis y los movimientos de braquiación ya no les eran útiles, por lo que recurrieron de nuevo a la marcha cuadrúpeda, esta vez apoyados sobre la cara dorsal de las falanges medias de los dedos de las manos (knuckle-walking), como en los actuales gorilas y chimpancés. La columna vertebral de aquellos primates sólo poseía una ligera curvatura dorso-lumbar de concavidad anterior (fig. 3 izquierda).
Hace unos 4 Ma surgieron los Australopithecus, los homínidos bípedos más antiguos conocidos. Actualmente no existe consenso entre los antropólogos sobre el origen de los Australopithecus. Unos defienden que evolucionaron a partir de primates cuadrúpedos terrestres mientras otros abogan por los primates braquiadores bípedos que caminaban erguidos por los árboles.
Los Australopithecus todavía pernoctaban en los árboles.(17) Su pelvis era más corta que la de sus ancestros y similar a la del hombre moderno. Su columna lumbar estaba constituida por 5-6 vértebras lumbares, más larga que en los gorilas y chimpancés (con 3-4 vértebras). Caminaban ligeramente inclinados hacia delante ya que todavía no presentaban la curvatura lordótica lumbar propia de los humanos.
Hombre moderno: Finalmente, hace unos 200.000 años, surgió el Homo sapiens, el hombre moderno. El hombre es el único primate que camina completamente erguido gracias a su lordosis (curvatura vertebral de concavidad posterior) lumbar (fig. 3 derecha), que aproxima la línea de carga al centro de gravedad corporal (situado en el interior de la pelvis, próximo a S2).
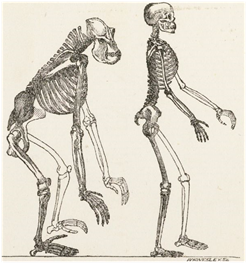 |
| Fig. 3 Izquierda. Esqueleto del gorila. Ligera curvatura dorso-lumbar de concavidad anterior y cuerpo inclinado. Derecha. Esqueleto humano. Lordosis lumbar y postura erguida. Dibujos realizados en 1863 por Waterhouse.(18) |
Los humanos conservan gran parte de las estructuras anatómicas de sus ancestros braquiadores. Como recuerda Arsuaga:(17) «En gran medida somos morfológicamente unos braquiadores de cintura para arriba, y unos bípedos de cintura para abajo (incluida la pelvis), aunque las curvaturas de nuestra columna vertebral sean una adaptación a la marcha de pie».
Los humanos no son buenos nadadores, corredores terrestres, trepadores ni braquiadores, pero en cambio son los únicos animales que pueden desplazarse utilizando cualquiera de estas cuatro modalidades de locomoción, lo que les confiere una gran versatilidad para explorar diferentes ambientes.(19)
ONTOGENIA DE LA COLUMNA VERTEBRAL Y DE LA MÉDULA ESPINAL
En el 16º día de gestación del embrión humano el ectodermo se engrosa, dando lugar a la placa neural. Poco después se forma el surco neural y entre los días 19 y 21 el tubo neural, del que surgirá el cerebro y la médula espinal. Durante los días 20 y 21 la cabeza se flexiona hacia adelante (ventralmente). El 27º día se cierran los dos neuroporos del tubo neural. Entre los días 28 y 30 el cuerpo se habrá plegado por completo, dando lugar a una única curvatura ventral. En la 5ª semana de gestación aparecen los primeros esbozos de las cuatro extremidades cuyas formas recuerdan las aletas de los peces.
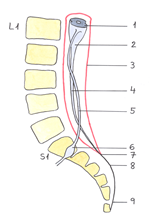
Durante las primeras semanas de gestación, la médula espinal y el canal raquídeo del embrión poseen la misma longitud (fig. 4). A partir de la 8ª semana el crecimiento de la médula espinal es más lento que el de la columna vertebral, dando lugar a un ascenso aparente del CM por el interior del canal vertebral. En su ascenso, el CM arrastra tras de sí las raíces de los nervios raquídeos (fig. 7.5) y el extremo caudal de la duramadre (fig. 7.7) y piamadre espinales, originando la cola de caballo y el filum terminale (fig 7.8).
En la 16ª semana el CM ya se encuentra a nivel de S1-S2 (fig. 5), en el recién nacido en L3 (fig. 6) y en el adulto habitualmente entre L1-L2 (fig. 7).
En la infancia y adolescencia el ascenso del CM puede tensar las raíces de los nervios raquídeos lumbosacros, produciendo dolor y otros trastornos neurológicos. (20-21)
 |
| Fig. 4. Primeras semanas del embrión. La médula y el canal raquídeo poseen la misma longitud. |
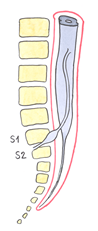 |
| Fig. 5. Embrión de cuatro meses. CM en S1-S2. |
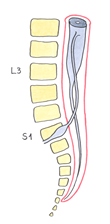 |
| Fig. 6. Recién nacido. CM en L3. |
| |
|
|Fig. 7. Adulto. CM en L1-L2.|
-1. Médula espinal.
-2. Conus medullaris o Cono medular.
-3. Duramadre.
-4. Filum terminale internum (en el interior del saco dural).
-5. Raíz nerviosa.
-6. Ganglio nervioso.
-7. Fondo de saco dural.
-8. Filum terminale externum (en el exterior del saco dural).
-9. Ligamento coxígeo.
La columna vertebral del recién nacido (fig. 8a) presenta una curvatura de concavidad ventral y un CM situado en L2-L3. A la edad de 3 meses empieza a desarrollarse una curvatura cervical lordótica (concavidad posterior) que le habilita para girar la cabeza.
Entre el 5º y 13º mes la columna lumbar se endereza (fig. 8b). Hacia el 6º-10º mes (fig. 8c) el niño gatea, apoyándose sobre las manos. Poco después empieza a caminar erguido sobre sus pies.
A partir de los 3 años (fig. 8d) se inicia la formación de la curvatura lordótica lumbar, adoptando su forma definitiva a los 10 años (fig. 8f).
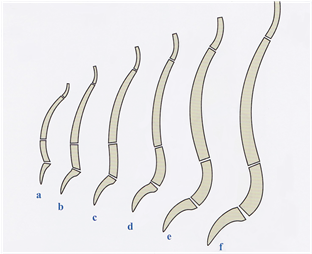 |
| Fig. 8. Ontogénesis de las curvaturas de la columna vertebral. Reproducida de Kapandji (22) con la autorización de Editorial Maloine. |
-a – 1 día
-b – 5 meses
-c – 13 meses
-d – 3 años
-e – 8 años
-f – 10 años
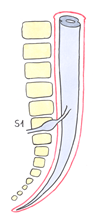
La columna vertebral del adulto posee 4 curvaturas (cervical, dorsal, lumbar y sacra) y el CM está situado entre L3 y D12 (frecuentemente en L1-L2). La médula espinal mide 42 – 45 cm y el filum 20 cm. La duramadre y la aracnoides se extienden hasta S2.
RECAPITULACIÓN DE LA FILOGENIA Y ONTOGENIA
La filogenia y la ontogenia humanas evidencian la existencia de una estrecha relación entre el nivel del CM y los movimientos de la columna vertebral.
A lo largo de la evolución de los vertebrados el CM va ascendiendo progresivamente por el interior del canal vertebral, paralelamente al aumento de la amplitud en los movimientos de flexión anteroposterior y rotación del raquis.
Los peces, los primeros vertebrados, poseen una columna vertebral rectilínea que sólo les permite realizar movimientos de lateroflexión del raquis. En ellos, la columna y la médula tienen la misma longitud.
Los anfibios urodelos (salamandra y tritón) caminan a 4 patas con movimientos de lateroflexión de su columna y cola (fig. 1B) y, como en los peces, la columna y la médula tienen aproximadamente la misma longitud.
A medida que ascendemos en la escala filogenética de los vertebrados, aparecen otros tipos de movimientos tales como la flexión anteroposterior y la rotación del raquis. Dentro de un mismo grupo taxonómico, las especies con mayor amplitud en los movimientos de su columna vertebral tienen el CM situado a un nivel superior. Por ejemplo, los equidnas y los lobos marinos realizan grandes movimientos de flexión y rotación, localizándose su CM a nivel torácico.
El hombre es un caso especial entre los homínidos ya que su lordosis lumbar le permite realizar movimientos simultáneos de rotación y contrarrotación de la columna. Entre los homínidos estudiados, el hombre es el que tiene el CM a un nivel más alto.
En la ontogenia humana también podemos observar esta relación directa entre movimientos vertebrales y localización del CM. Durante el desarrollo embrionario, el nivel del CM va ascendiendo por el interior del canal vertebral a medida que el embrión aumenta el grado de flexión del raquis. La columna lumbar del bebé recapitula la evolución de la columna en los homínidos. Mientras el bebé gatea, la columna es rectilínea y apenas se producen cambios en el nivel del CM. Cuando empieza a caminar erguido van surgiendo curvaturas en la columna, a la vez que sigue ascendiendo el CM. El ascenso finalizará cuando la lordosis lumbar se encuentre totalmente consolidada.
BIOMECÁNICA DE LA COLUMNA VERTEBRAL Y MÉDULA ESPINAL EN EL HOMBRE
Para completar nuestro estudio sobre el nivel del CM, repasemos brevemente algunos aspectos de la biomecánica de la marcha bípeda. Las carillas articulares de L4 y L5 están orientadas verticalmente, impidiendo que las vértebras giren sobre su eje axial. Lovett (23) descubrió que las vértebras lumbares giran durante los movimientos de lateroflexión de la columna lumbar. El sentido de giro varía según la posición en que previamente se encuentre la columna: en posición anatómica y en flexión ventral las vértebras lumbares giran en sentido contrario al de la lateroflexión mientras que en posición de flexión dorsal giran en el mismo sentido de la lateroflexión.
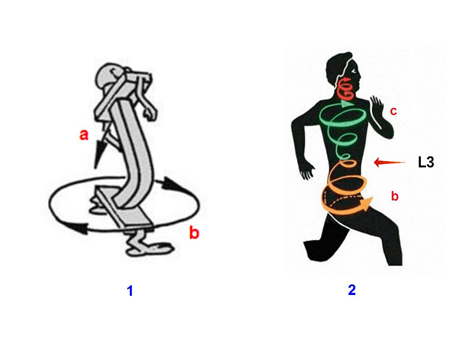 |
| Fig. 9. Movimientos de rotación y contrarrotación de las cinturas escapular y pélvica durante la marcha. Imagen reproducida con la autorización de Serge Gracovetsky. |
Según Gracovetsky (24), en cada paso de la marcha se producen tres movimientos sincrónicos (fig. 9):
– lateroflexión de la columna lumbar del lado del pie adelantado (izquierdo) (fig. 9. 1a)
– giro de la cintura pélvica en sentido contrario al pie adelantado: de izquierda a derecha (fig. 9.1b) y de derecha a izquierda (fig. 9.2b)
– giro de la cintura escapular en el mismo sentido del pie adelantado (de izquierda a derecha) (fig. 9.2c)
Así, cintura pélvica y escapular giran en sentido contrario como si fueran dos compases abiertos unidos por sus bisagras a nivel de L3, el vértice de la lordosis lumbar (fig. 10).
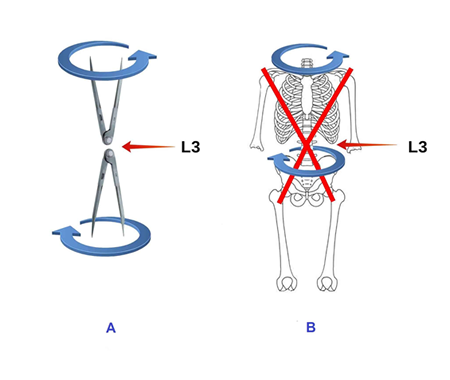 |
| Fig. 10 A – Movimientos de rotación y contrarrotación de dos compases que contactan a través de sus bisagras (L3). B – En L3 se unen las bisagras de dos compases. El superior gira en el sentido de la cintura escapular. El inferior en el sentido de la cintura pélvica. |
L3 es la vértebra con mayor movilidad de la columna lumbar. Sus carillas articulares están horizontalizadas y paralelas entre sí, permitiéndole una gran capacidad de rotación. (22) Está situada cerca del centro de gravedad corporal. Funcionalmente es un punto de transición entre la zona superior e inferior del raquis. Según Kapandji.(22) L3 sirve de relevo muscular entre los haces lumbares del dorsal ancho (se insertan en las apófisis transversas de L3) y los haces del espinoso dorsal (se inserta en la apófisis espinosa de L3) (fig. 11).
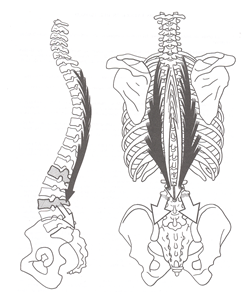 |
| Fig. 11. L3 es una vértebra de transición, anatómica y funcionalmente, donde confluyen parte de la musculatura superior e inferior del raquis. Imagen original de Kapandji.(22 Reproducida con la autorización de Editorial Maloine.) |
¿POR QUÉ EL CONO MEDULAR HUMANO SE ENCUENTRA SITUADO POR ENCIMA DE L3?
Según Rubinstein(25) (citado por Roth),(26) la escasa sensibilidad del tejido nervioso a la hormona del crecimiento es la responsable de la asincronía entre el crecimiento de la columna vertebral y de la médula espinal. En los mamíferos, esta hipótesis no explicaría la variabilidad en el nivel del CM que podemos encontrar entre algunas especies de un mismo grupo taxonómico. Como veremos a continuación, una posible explicación de la localización del CM humano por encima de L3 es la de evitar torsiones medulares que puedan lesionar la médula espinal cuando se producen movimientos de rotación y contrarrotación de la columna vertebral.
La médula espinal se mantiene suspendida en el interior del canal vertebral mediante los ligamentos dentados, las fijaciones de las raíces nerviosas y el filum terminale. Los movimientos de flexión y rotación de la columna vertebral producen tracciones y rotaciones medulares que reducen el calibre de los vasos sanguíneos medulares (fig. 13). (27) Los axones y los vasos sanguíneos medulares están dispuestos en zig-zag (fig. 12) para evitar que los movimientos del raquis lesionen la médula.(27)
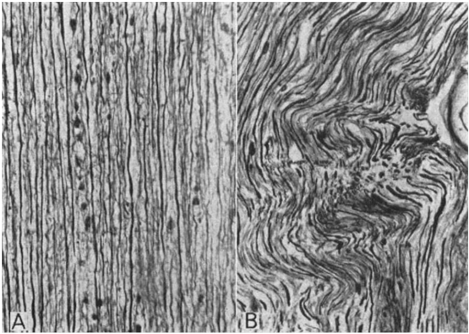 |
| Fig. 12. Corte sagital de la médula espinal cervical a nivel de C6. A (izquierda). Flexión ventral. Los axones medulares se enderezan y tensan. B (derecha). Flexión dorsal. Los axones medulares se pliegan en zig-zag. With permission, Breig 1978, Shacklock 2007. (28) |
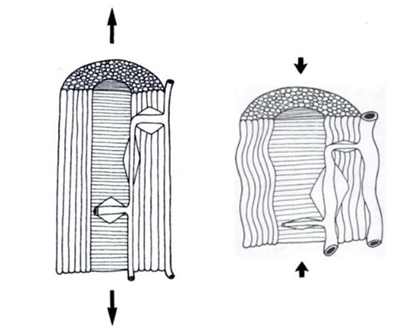 |
| Fig. 13. Vasos sanguíneos espinales. Izquierda. Los movimientos de flexión ventral de la columna vertebral tensan la médula, reduciendo el calibre y el flujo en los vasos sanguíneos. Derecha. Los movimientos de flexión dorsal de la columna vertebral disminuyen la tensión medular, aumentando el calibre y el flujo en los vasos sanguíneos. With permission, Breig 1978, Shacklock 2007. (28) |
Si la médula espinal ocupara por completo el interior del canal vertebral (fig. 15 B), los movimientos de rotación y contrarrotación de la columna producidos durante la marcha torsionarían la médula de forma similar a una toalla que retorciéramos con las manos (fig. 14). Tras múltiples torsiones, se produciría una isquemia y lesión de los tejidos medulares.
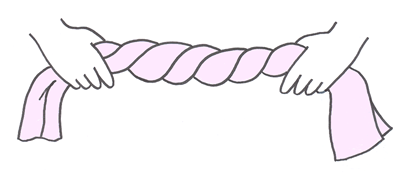 |
| Fig. 14. Movimientos de rotación y contrarrotación de las manos torsionando una toalla. |
Una solución biomecánica para evitar la torsión medular es situar el CM por encima del punto neutro (con respecto a la rotación y contrarrotación) de la columna lumbar (fig. 15 C) es decir, por encima de L3, de forma que toda la médula gire en un único sentido (el de la cintura escapular).
Las enfermedades congénitas que, como la médula anclada (tethered cord syndrome), presentan adherencias de la médula, meninges y filum terminale a las paredes del canal vertebral, favorecen la aparición de torsiones medulares, mediante un mecanismo parecido al de la figura 15 B.
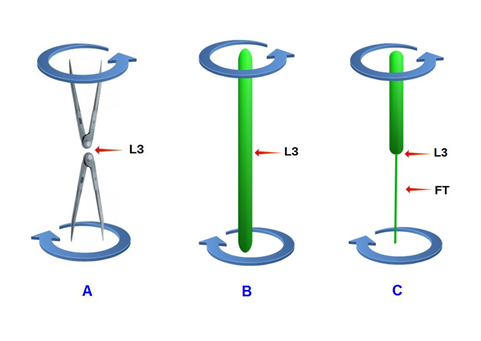 | Fig. 15 A – Movimientos de rotación y contrarrotación de dos compases que contactan a nivel de sus bisagras. B – Médula espinal ocupando por completo el interior del canal vertebral lumbar (CM situado por debajo de L3). Los movimientos de rotación y contrarrotación de las cinturas pélvica y escapular torsionan la médula espinal. C – La médula espinal ocupa la zona superior del canal vertebral lumbar (CM situado por encima de L3). El filum terminale (FT) está situado por debajo de L3. La médula rota en el mismo sentido que la cintura escapular, por lo que no se producen torsiones medulares. |
CONCLUSIONES
A pesar de los grandes avances en la anatomía y fisiología del SNC, todavía queda mucho por investigar en el campo de la biomecánica de la médula espinal.
En el transcurso de la evolución surgieron especies de vertebrados capaces de realizar movimientos de rotación y flexión antero-posterior de la columna vertebral, siendo su médula espinal más corta que su columna vertebral. Este acortamiento relativo de la médula con respecto a la columna fue una eficaz estrategia evolutiva destinada a evitar que los movimientos de torsión medular producidos durante la marcha lesionaran la médula.
La anatomía comparada nos permite constatar que a mayor amplitud de dichos movimientos de columna, menor longitud de la médula espinal con respecto a la columna vertebral y, por consiguiente, el CM está situado a un nivel superior.
¿Qué interés médico tiene conocer los motivos por los cuales el CM humano se sitúa por encima de L3? Su interés radica en aportar una mayor comprensión fisiopatológica de las mielopatías isquémicas del Tethered cord syndrome y de ciertas siringomielias lumbares.
Entendiendo cómo afectan los movimientos corporales a la fisiología del SNC podremos diseñar tratamientos médicos y quirúrgicos (artrodesis, corsés ortopédicos, rehabilitación, osteopatía, quiropraxia, etc) menos yatrogénicos. Puede ser también de utilidad en la práctica deportiva, ya que podremos diseñar ejercicios físicos saludables adaptados a las peculiaridades de cada tipo de espalda.
BIBLIOGRAFÍA
1- Saifuddin A, Burnett S, White J. The variation of position of the conus medullaris in an adult population. A magnetic resonance imaging study. Spine (Phila Pa 1976). 1998;23(13):1452-6.
2- Haeckel, E. Generelle morphologie der Organismen. Allgemeine Grundzüge der organischen Formen-wissenschaft, mechanisch begründet durch die von Charles Darwin reformirte Descendenz-theorie. Berlin: Verlag von Georg Reimer; 1866
3- Tubbs RS, Rizk E, Shoja MM, Loukas M, Barbaro N, Spinner RJ, eds. Nerves and nerve injuries. Vol 1: history, embryology, anatomy, imaging, and diagnostics: Waltham, MA: Academic Press (Elsevier); 2015.
4- Lima A, Fioretto E, Fontes R, Imbeloni A, Muniz J, Branco E. Caring about medullary anesthesia in Saimiri sciureus: the conus medullaris topography. Anais Acad. Bras. Cienc. 2011; 83:1339-1343.
https://www.scielo.br/pdf/aabc/v83n4/19.pdf. Accessed June ,1 2021.
5- Santos A, et al. Topografia do cone medular em equinos (Equus caballus). Paper presented in: XV Congresso Panamericano de Ciencias Veterinarias; 1996; Campo Grande, Brasil. Abstracts. Campo Grande, Brasil. 1996; 118.
6- Silva P, Silva RM, Lima E. Topografia do cone medular em gatos sem raça definida. Arquivo Brasileiro de Medicina Veterinária e Zootecnia. 2009; 61(5): 1062–1066.
https://www.scielo.br/pdf/abmvz/v61n5/a08v61n5.pdf. Accessed June ,1 2021.
7- Scavone ARF, Guimaraes GC, Rodrigues VHV, Sasahara THC, Machado MRF. Topografia do cone medular da paca (Agouti paca, Linnaeus – 1766). Braz J Vet Res An Sci . 2007; 44: 53–57.
http://www.periodicos.usp.br/bjvras/article/download/26590/28373. Accessed June ,1 2021.
8- Rao GS, A study of spinal cord segments in the Indian Buffalo. J Anat Soc India. 1976;16: 43–50.
9- Machado G, Lesnau G, Birck A. Topografia do cone medular no lobo-marinho (Arctocephalus australis Zimmermann, 1803). Arq Cien Vet Zool. 2003; 6: 11–14.
https://revistas.unipar.br/index.php/veterinaria/article/download/787/687. Accessed June ,1 2021.
10- Ashwell KW. Overview of the monontreme nervous system structure and evolution. In: Neurobiology of monotremes: Brain Evolution in our Distant Mammalian Cousins. Ed. Ashwell KW, Collingwood: CSIRO. 2013;69–106.
11- Kappers C, Huber G, Crosby E. The Comparative Anatomy of the Nervous System of Vertebrates including Man. New York: Macmillan; 1936.
12- Mitchelle A, Watson C. The organization of spinal motor neurons in a monotreme is consistent with a six-region schema of the mammalian spinal cord. J Anat. 2016; 229(3):394–405.
https://onlinelibrary.wiley.com/doi/epdf/10.1111/joa.12492. Accessed June ,1 2021.
13- Arsuaga J, Martínez I. La especie elegida. La larga marcha de la evolución humana. Madrid: Temas de Hoy; 1998.
14- Martin R, Doyle G, Walker A. Prosimian Biology. London: Duckworth. Bearder S. K. & Doyle G. A; 1974.
15- Noback C, Harting J. Spinal Cord (spinal medulla). Primatologia – Handbook of Primatology. Vol 2, Part 2, Delivery 2. Basel: Karger; 1971.
16- Böhme M, Spassov N, Fuss J, et al. A new Miocene ape and locomotion in the ancestor of great apes and humans. Nature. 2019; 575: 489–493.
http://www.wahre-staerke.com/ madelaine/Danuvius_guggenmosi.pdf. Accessed June ,1 2021.
17- Arsuaga J. Veritas Praevalebit. El hombre y el mono. Ars Medica. 2002;1(1):24-34.
https://www.fundacionpfizer.org/sites/default/files/ars_medica_2002_vol01_num01_024_034_arsuaga_1_1.pdf. Accessed June ,1 2021.
18- Huxley T. Evidences as to Man’s Place in Nature. New York: Appleton and Company; 1863.
19- Avis V. Brachiation: The crucial issue for man’s ancestry. Southwestern Journal of Anthropology. 1962;18:119-148.
20- Matzen PF, Polster J. The symptom complex “Hüft-Lenden-Strecksteife”. Arch orthop Unfall-Chir. 1960; 51: 399-409.
21- Polster J, Buesenez EK. Causes and significance of the symptom “Hüft-Lenden-Strecksteife”. Orthop Praxis. 1972;11:273–278.
22- Kapandji I. Physiologie articulaire. Paris: Maloine; 1975.
23- Lovett R. The mechanism of the normal spine and its relation to scoliosis. Bos. med. Surg. J. 1905; 153: 349-358.
https://zenodo.org/record/1839677#.YKyTZ6gzbIV. Accessed June ,1 2021.
24- Gracovetsky S. The Spinal Engine. Wien, Nueva York: Springer-Verlag; 1988.
25 Rubinstein H. The effect of the growth hormone upon the brain and brain weight-body weight relation. J Comp Neurol . 1936; 64:469–496.
26- Roth M. Idiopathic scoliosis from the point of view of the neuroradiologist. Neuroradiology. 1981;21: 133-138.
27- Breig A. Adverse Mechancial Tension in the Central Nervous System. Stockholm: Alqvist & Wiksell; 1978.
28- Shacklock M. Biomechanics of the Nervous System: Breig Revisited. Adelaide: Neurodynamic Solutions NDS; 2007.
AGRADECIMIENTOS
Agradezco a:
– Prof. Antonio Zorzano (University of Barcelona, and IRB Barcelona) por su asesoramiento.
– Carmen Prats Rocavert (MD. BSc Biological Science) por su colaboración.
El autor ha respetado las leyes de la propiedad intelectual y agradece a los propietarios de las imágenes de este artículo sujetas a copyright la autorización para publicarlas.
FINANCIACIÓN
Este estudio no ha recibido financiación de organizaciones públicas ni privadas.
CONFLICTO DE INTERESES (CONFLICT OF INTEREST )
El autor no pertenece a organizaciones académicas o empresariales relacionadas con el tema tratado en el artículo.


